Enhertu pentru cancerul pulmonar: Unde este aprobat și cum se obține?
Ultima actualizare: 15 iulie 2024
Puteți avea acces legal la medicamente noi, chiar dacă acestea nu sunt aprobate în țara dumneavoastră.
Aflați cumEnhertu (fam-trastuzumab deruxtecan-nxki) a fost unul dintre tratamentele împotriva cancerului de urmărit, încă de la prima sa aprobare de către FDA în 2019 1.
Deoarece siguranța și eficacitatea Enhertu în cazul cancerului ovarian și al cancerului colorectal sunt încă în curs de investigare, medicamentul este deja aprobat pentru mai multe indicații. Inclusiv cancerul de sân HER2-pozitiv, cancerul gastric HER2-pozitiv și cancerul de sân cu HER2 scăzut. FDA a aprobat, de asemenea, Enhertu pentru cancerul pulmonar cu celule non-mici HER2-mutant. CHMP din Europa a dat recent un aviz pozitiv pentru a face același lucru în cadrul UE 2.
Dacă sunteți un pacient cu cancer pulmonar din Marea Britanie sau din alte țări din afara SUA și UE, probabil vă întrebați când va fi disponibil și pentru dumneavoastră Enhertu .
Iată tot ce trebuie să știți despre Enhertu pentru cancerul pulmonar și la ce se pot aștepta pacienții din Marea Britanie și din restul lumii.
Care este indicația pentru Enhertu pentru cancerul pulmonar?
Ca terapie țintită, Enhertu este destinat doar pentru tratarea cancerelor cu mutație HER2. Ca atare, tratamentul se aplică la aproximativ 2% din totalul pacienților cu NSCLC 3.
Enhertu este indicat ca monoterapie la pacienții adulți cu NSCLC avansat ale căror tumori prezintă o mutație HER2 (ERBB2) activatoare. Enhertu se adresează pacienților care au primit o terapie sistemică anterioară și al căror cancer fie s-a răspândit în alte părți ale corpului, fie nu poate fi îndepărtat chirurgical 2.
Care este rata de succes a Enhertu pentru cancerul pulmonar?
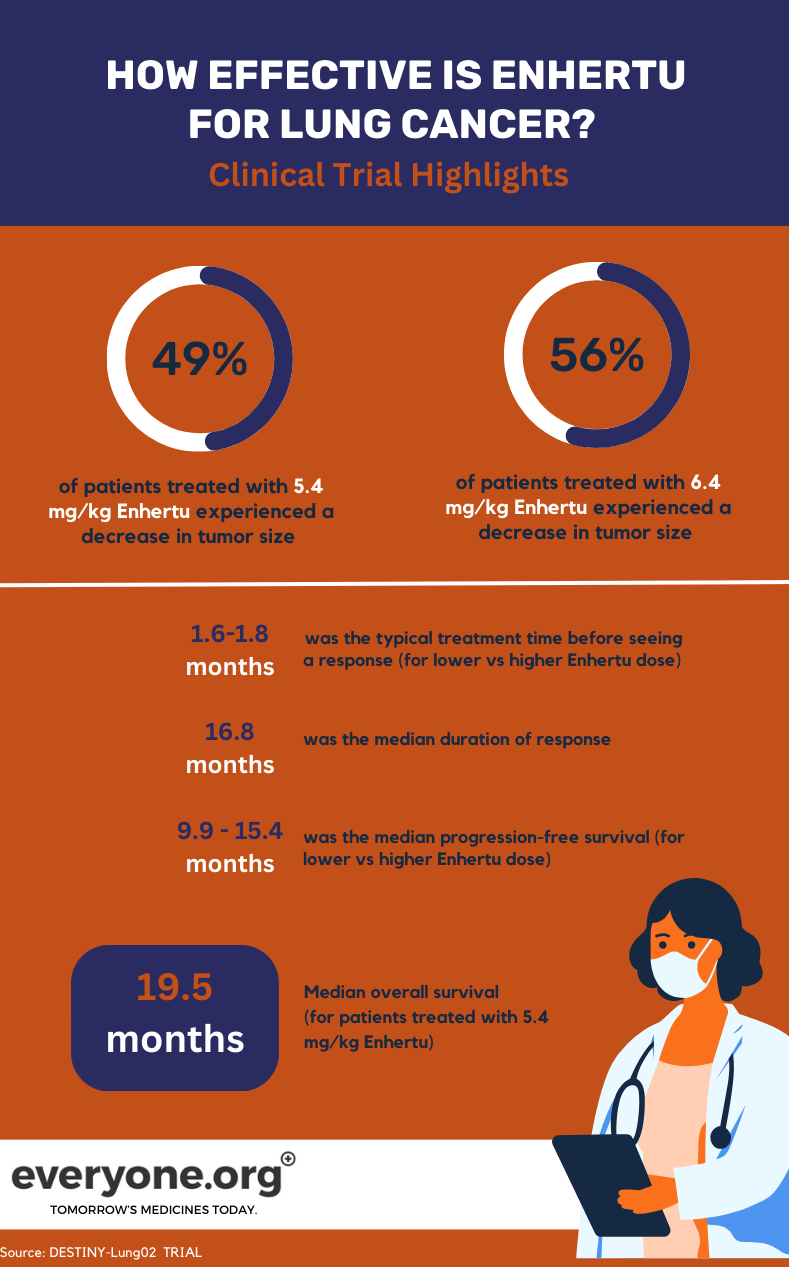
Studiul de fază II DESTINY-Lung02, aflat în curs de desfășurare, investighează siguranța și eficiența Enhertu în tratamentul NSCLC cu mutație HER2. În cadrul studiului, sunt comparate două doze de Enhertu (5,4 mg/kg și 6,4 mg/kg).
Pentru pacienții cu cancer pulmonar, rezultatele preliminare cheie ale studiului DESTINY-Lung02 sunt:
- Tumorile s-au micșorat la 49% dintre pacienții tratați cu doza mai mică Enhertu și la 56% dintre cei tratați cu doza mai mare.
- Tumorile au dispărut complet la 1% și 4% dintre pacienții din grupul cu doze mai mici și, respectiv, mai mari.
- Durata mediană a răspunsului a fost de 16,8 luni pentru pacienții din grupul cu doza mai mică Enhertu . Pentru pacienții din celălalt grup, DoR a fost raportată ca neevaluabilă.
- Timpul median necesar pentru a observa răspunsul inițial la tratament a fost de 1,8 luni și 1,6 luni în grupul cu doze mai mici și, respectiv, mai mari.
- Supraviețuirea mediană fără progresie a fost de 9,9 luni la 5,4 mg/kg și de 15,4 luni la 6,4 mg/kg 4.
Care a fost supraviețuirea mediană pentru pacienții Enhertu ?
Pentru pacienții care au primit doza mai mică Enhertu în cadrul studiului clinic, supraviețuirea generală (OS) mediană a fost de 19,5 luni. OS a fost raportată ca neevaluabilă pentru grupul cu doza mai mare 4.
Care sunt efectele secundare ale Enhertu asupra plămânilor?
La pacienții Enhertu au fost raportate unele cazuri severe, care pun în pericol viața sau sunt fatale, de boală pulmonară interstițială (ILD). Pacienții cu insuficiență renală moderată pot prezenta un risc mai mare 6.
În cadrul studiului DESTINY-Lung02, ILD a fost raportată la 12,9% dintre pacienții din grupul cu doze mai mici și la 28% dintre pacienții din grupul cu doze mai mari. Majoritatea acestor cazuri nu au fost severe. ILD de gradul 3 sau mai mare a fost raportată la 2% dintre pacienții din ambele grupuri de pacienți.
EnhertuProfilul de siguranță al medicamentului pentru cancerul pulmonar este similar cu performanțele sale în alte indicații. Pe baza incidenței mai scăzute a efectelor adverse (38,6% față de 58%), doza de 5,4 mg/kg este considerată tratamentul optim pentru pacienții cu NSCLC 4.

Unde este aprobat Enhertu pentru cancerul pulmonar?
În prezent, Enhertu este aprobat în SUA, UE, Israel și Japonia pentru tratamentul pacienților adulți cu NSCLC nerezecabil sau metastatic ale căror tumori prezintă mutații HER2 (ERBB2) activatoare 4.
Este Enhertu aprobat pentru cancerul pulmonar în Marea Britanie?
Din iulie 2024, nu încă. Un proiect final de orientare publicat de NICE în martie 2024 a anunțat că Enhertu nu va fi pe NHS până când nu va fi disponibil un preț rentabil. Între timp, din păcate, Enhertu nu este disponibil în Regatul Unit pentru cancerul pulmonar 7.
Poate medicul meu să prescrie Enhertu pentru cancerul pulmonar dacă nu este încă aprobat?
Răspunsul scurt este da.
Enhertu a fost deja aprobat în mai multe țări pentru tratamentul NSCLC cu mutație HER2. Pe baza acestui fapt, medicul dumneavoastră are autoritatea de a prescrie medicamentul pentru această indicație, chiar dacă nu este încă aprobat în țara dumneavoastră.
Atunci când un medic prescrie un medicament pentru tratarea unei boli pentru care acesta nu este aprobat (încă), acest lucru se numește utilizare off-label. O rețetă pentru utilizare off-label poate fi dificil de onorat în unele țări, în funcție de reglementările locale și de disponibilitate. Cu toate acestea, este întotdeauna posibil să o furnizați folosind regulamentul privind importul de pacienți numiți.
Medicul dumneavoastră a luat decizia de a vă prescrie Enhertu pentru tratamentul cancerului pulmonar? Echipa noastră de la www.everyone.org vă poate ajuta să aveți acces la acest medicament. Suntem specializați în procurarea și livrarea medicamentelor prescrise care nu sunt aprobate sau nu sunt disponibile în țara pacientului. Contactați-ne, ca să vă putem ajuta.
Referinţe:
- Stewart, Judith. Enhertu (fam-trastuzumab deruxtecan-nxki) Istoricul aprobării FDA. Drugs.com, 15 august 2022.
- Enhertu. Agenția Europeană pentru Medicamente, accesat la 06 noiembrie 2023.
- HER2 și cancerul pulmonar. American Lung Association, accesat la 6 noiembrie 2023.
- Enhertu ademonstrat răspunsuri tumorale puternice și durabile în cazul cancerului pulmonar avansat HER2-mutant tratat anterior în cadrul studiului de fază II DESTINY-Lung02. AstraZeneca, 11 septembrie 2023.
- Informații despre proiect | Trastuzumab deruxtecan pentru tratamentul cancerului pulmonar nescuamoase cu celule mici nerezecabile sau metastatice HER2-mutate, nerezecabile sau metastatice, după 1 sau mai multe terapii [ID3934] | Ghid. NICE, accesat la 6 noiembrie 2023.
- USPI-DB-04 CDX Update FINAL. Daiichi Sankyo, accesat la 6 noiembrie 2023.
- UK NICE respinge Daiichi Sankyo's Enhertu pentru cancerul de sân, Pharmaceutical Technology, accesat la 15 iulie 2024.