Care este diferența dintre Leqembi și Aduhelm? O prezentare generală simplă.
Ultima actualizare: 19 noiembrie 2024
Puteți avea acces legal la medicamente noi, chiar dacă acestea nu sunt aprobate în țara dumneavoastră.
Aflați cumÎncepând din 2021, FDA a acordat aprobare accelerată pentru două noi medicamente pentru boala Alzheimer. Aceste medicamente sunt terapiile anti-amiloide Leqembi (lecanemab) și Aduhelm (aducanumab). Ambele aprobări au venit după aproape 20 de ani fără progrese majore în tratamentul Alzheimer. Din acest motiv, ambele medicamente au beneficiat de o largă atenție din partea mass-media.
Cu toate acestea, primirea a fost mixtă. Maria Carrillo, Chief Science Officer pentru Alzheimer's Association, s-a referit la aprobările noilor medicamente ca la "o etapă importantă pentru persoanele eligibile pentru acest tratament" [2]. În același timp, procesul de aprobare a acestora a fost înconjurat de controverse, în special în cazul lui Aduhelm [1, 4].
Ca pacient, vă întrebați probabil care este diferența dintre Leqembi (lecanemab) și Aduhelm (aducanumab). În acest articol, vom compara cele două medicamente cu privire la modul în care funcționează, eficacitatea lor, precum și costul și disponibilitatea lor.
Leqembi vs Aduhelm: Pentru ce sunt folosite?
Ambele medicamente sunt tratamente pentru boala Alzheimer incipientă. Acestea sunt terapii anti-amiloide și vizează plăcile amiloide din creier.
Conform informațiilor de prescriere, Leqembi și Aduhelm sunt destinate pacienților cu insuficiență cognitivă ușoară și cu niveluri crescute confirmate de beta-amiloid [5].
Leqembi vs Aduhelm: Cum funcționează?
Similitudini
Leqembi (lecanemab) și Aduhelm (aducanumab) sunt ambii anticorpi monoclonali. Acestea sunt concepute pentru a viza plăcile beta-amiloide care se acumulează în creierul pacienților cu Alzheimer. Se consideră că aceste plăci contribuie la declinul cognitiv și la declinul clinic observate în această boală.
Ambele medicamente se leagă de plăcile amiloide și le neutralizează, cu scopul de a încetini evoluția bolii. Aceasta este ceea ce face ca Leqembi și Aduhelm să fie fundamental diferite de tratamentele anterioare pentru Alzheimer, cum ar fi galantamina, rivastigmina și donepezil. Aceste tratamente anterioare se concentrează pe ameliorarea simptomelor bolii. Leqembi și Aduhelm urmăresc să schimbe evoluția bolii prin atacarea cauzei sale profunde.
Diferențe
Leqembi și Aduhelm se leagă de părți diferite ale proteinei beta-amiloide. Aduhelm se leagă mai puternic de plăcile amiloide mai mari, întărite. Se pare că Leqembi vizează mai bine forma mai mică, solubilă (și mai toxică) a proteinei amiloide [6].
Cât de eficienți sunt Leqembi și Aduhelm?
Eficacitatea Leqembi(lecanemab) și Aduhelm(aducanumab) a fost studiată în studii clinice.
-
Rezultatele studiului clinic Leqembi
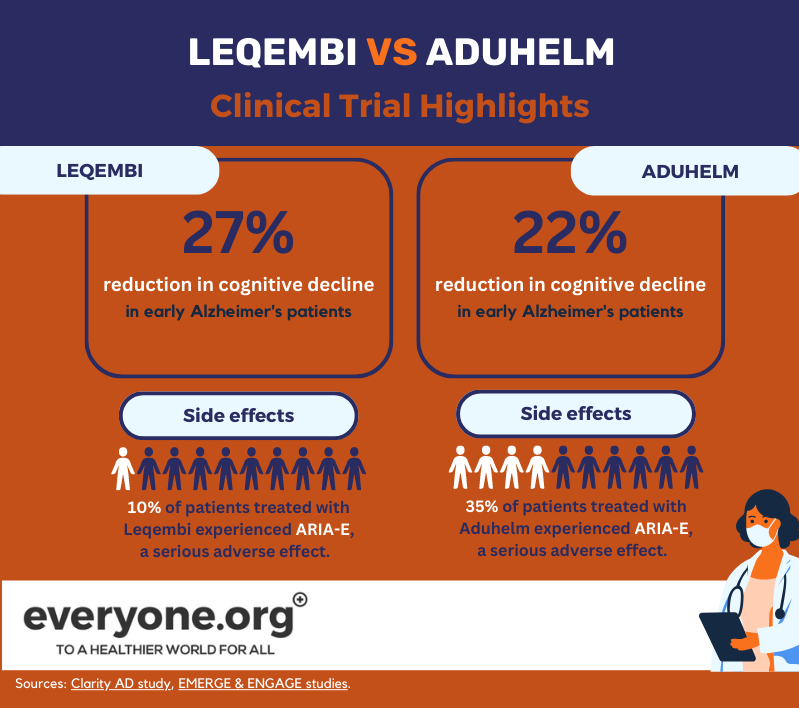
Aprobarea accelerată a Leqembi de către FDA s-a bazat pe rezultatele de top pozitive din studiul de fază 3 Clarity AD. Conform acestor rezultate, Lecanemab a încetinit declinul cognitiv cu până la 27% la pacienții cu Alzheimer precoce, comparativ cu placebo. Aceste rezultate au fost măsurate la 18 luni după începerea tratamentului [8].
O analiză suplimentară a rezultatelor studiului a fost publicată în aprilie 2023. Aceasta a arătat că, chiar și după ce pacienții au încetat să ia Leqembi pentru o perioadă de 9 până la 59 de luni, aceștia au continuat să beneficieze de o întârziere a declinului cognitiv. În timpul acestei "perioade de întrerupere", boala Alzheimer părea să progreseze la o rată constant mai lentă la pacienții care au primit Leqembi în studiul clinic inițial, comparativ cu cei care au primit placebo [7].
Efectul advers grav ARIA-E a apărut la 10% dintre pacienții tratați cu Leqembi. 6% dintre pacienții din studiu au prezentat ARIA-H, un alt efect advers grav [13].
-
Rezultatele studiului clinic Aduhelm
FDA a acordat aprobarea sa accelerată pentru Aduhelm pe baza a două studii clinice de fază 3. Unul dintre acestea (EMERGE) a arătat o reducere a declinului clinic al pacienților cu până la 22% [12]. Celălalt (ENGAGE) nu a făcut-o. Cu toate acestea, în ambele studii, Aduhelm a demonstrat o reducere a plăcilor amiloide din creier [9]. FDA a decis că această indicație este "rezonabil de probabil să conducă la [un] beneficiu clinic" [10].
Un studiu de confirmare de fază 4 (ENVISION) a început în iunie 2022, conform solicitării FDA. Rezultatele sunt așteptate în 2026 [9].
Conform informațiilor de prescriere ale Aduhelm, 35% dintre pacienții care au primit medicamentul în studiile clinice au prezentat ARIA-E. 34% dintre pacienții din studiile clinice au prezentat ARIA-H [15].
După cum arată aceste date actuale, principala diferență dintre Leqembi și Aduhelm în acest moment pare să fie în profilul lor de siguranță, Leqembi prezentând o incidență mai scăzută a efectelor adverse.
În același timp, pe baza datelor din studiile clinice actuale, Leqembi pare să aibă un efect mai consistent asupra declinului cognitiv. Rezultatele studiilor în curs atât pe Leqembi, cât și pe Aduhelm vor oferi mai multă claritate cu privire la performanța ambelor medicamente.
NOTĂ: Rezultatele prezentate aici sunt în scop informativ și nu trebuie utilizate ca bază pentru alegerea unui tratament. Medicul dumneavoastră este cel mai în măsură să stabilească tratamentul care se aplică cel mai bine cazului dumneavoastră.

Leqembi vs Aduhelm: Siguranță și efecte secundare
Conform informațiilor de prescriere, acestea sunt cele mai frecvente reacții adverse ale Leqembi (lecanemab) și Aduhelm:
Leqembi efecte secundare
- reacții legate de perfuzie, inclusiv febră, simptome asemănătoare gripei, greață, modificări ale ritmului cardiac și dificultăți de respirație;
- dureri de cap;
- Anomalii imagistice legate de amiloid (ARIA) [13]. ARIA pot implica umflături sau sângerări temporare în creier. Simptomele ARIA sunt dureri de cap, confuzie, convulsii, dificultăți de mers și amețeli. Purtătorii homozigoți ai genei apolipoproteinei E pot prezenta un risc mai mare de ARIA [14].
Efecte secundare ale Aduhelm
Cele mai frecvente reacții adverse ale Aduhelm sunt ARIA, dureri de cap și cădere. O reacție adversă specificată pentru Aduhelm dar nu și pentru Leqembi este hipersensibilitatea. Reacțiile de hipersensibilitate pot include angioedem (umflarea straturilor profunde ale pielii) și urticarie (erupție cutanată) [15].
Leqembi vs Aduhelm: Comparație de prețuri
Când vine vorba de medicamente care nu sunt încă disponibile pe scară largă, trebuie să luați orice preț doar ca o indicație. Costurile finale tind să varieze în funcție de locație, furnizori sau acoperirea de asigurare.
Pentru a vă face o idee, un flacon cu o singură doză de Leqembi costă aproximativ 1 043 EUR. Cu administrarea bisăptămânală recomandată a medicamentului, costurile anuale pentru o persoană se ridică la aproximativ 27 118 EUR [16].
Prețul orientativ al Aduhelm per flacon monodose este de 1 335 EUR. În ceea ce privește costurile anuale pentru o persoană, acestea se ridică la 34 710 EUR [17].
Unde sunt aprobați Leqembi și Aduhelm ?
Leqembi (lecanemab) este aprobat în prezent numai în SUA și Regatul Unit, aprobarea EMA fiind așteptată până la sfârșitul anului 2024[3]. Leqembi a depus, de asemenea, cereri de autorizare de introducere pe piață în China și Japonia [18, 19, 20].
Aduhelm (aducanumab) a primit aprobarea accelerată din partea FDA în SUA în iunie 2021. Agenția Europeană pentru Medicamente (EMA) a respins cererea de introducere pe piață a Aduhelm în decembrie 2021. Cererea a fost ulterior retrasă de Biogen în aprilie 2022 [21]. Ministerul Sănătății din Japonia a trimis, de asemenea, un semnal negativ cu privire la aprobarea Aduhelm în țară [22].
Leqembi sau Aduhelm nu sunt (încă) aprobate sau disponibile în țara dumneavoastră? Dacă dumneavoastră și medicul dumneavoastră sunteți de părere că aceste tratamente v-ar putea fi benefice, luați legătura cu echipa noastră de experți în acces medical. Vă putem oferi o ofertă de preț personalizată pentru procurarea medicamentului pentru dumneavoastră.
Referințe:
- Anticorpul monoclonal anti-amiloid Lecanemab: 16 note de precauție. Zenodo, 3 ianuarie 2023.
- Hamilton, Jon. FDA acordă medicamentului pentru Alzheimer Leqembi aprobare accelerată : Shots - Știri despre sănătate. NPR, 6 ianuarie 2023.
- Comitetul consultativ al FDA a votat în unanimitate pentru confirmarea beneficiului clinic al LEQEMBI® (lecanemab-irmb) pentru tratamentul bolii Alzheimer. Biogen | Relații cu investitorii, 9 iunie 2023.
- Helmore, Edward. FDA sub foc asupra aprobării medicamentului pentru Alzheimer Aduhelm. The Guardian, 29 decembrie 2022.
- PUNCTELE PRINCIPALE ALE INFORMAȚIILOR DE PRESCRIERE. Leqembi, accesat la 3 august 2023.
- Taylor, Emma. Lecanemab, un nou tratament împotriva bolii Alzheimer, face prima pagină a ziarelor: ce urmează? Alzheimer's Research UK, 13 decembrie 2022.
- Eisai: Pacienții cu Alzheimer văd beneficiile Leqembi chiar și atunci când acesta este oprit. CNBC, 6 aprilie 2023.
- Leqembi | ALZFORUM. Alzforum, 30 mai 2023, accesat la 3 august 2023.
- Aduhelm | ALZFORUM. Alzforum, 6 februarie 2023, accesat la 3 august 2023.
- Cavazzoni, Patrizia. Decizia FDA de a aproba un nou tratament pentru boala Alzheimer. FDA, 7 iunie 2021.
- Eisai prezintă rezultatele complete ale studiului de fază III Clarity AD cu lecanemab. Alzheimer Europe, 30 noiembrie 2022.
- Rezultatele inițiale ale studiilor EMERGE și ENGAGE: Two Phase 3 Studies to Evaluate Aducanumab in Patients With Early Alzheimer's Disease. Biogen | Relații cu investitorii, accesat la 3 august 2023.
- ID de referință: 5105416. Accessdata.fda.gov, accesat la 3 august 2023.
- GHID DE MEDICAMENTE LEQEMBI® (leh-kem'-bee) (lecanemab-irmb) injectabil, pentru uz intravenos. Leqembi, accesat la 3 august 2023.
- REZUMATE ALE INFORMAȚIILOR DE PRESCRIERE. Accessdata.fda.gov, accesat la 3 august 2023.
- Cumpărați Leqembi (lecanemab-irmb) online - Prețul și costurile. Everyone.org, accesat la 3 august 2023.
- Cumpărați Aduhelm (aducanumab-avwa) online - Prețul și costurile. Everyone.org, accesat la 3 august 2023.
- EISAI DEPUNE CEREREA DE AUTORIZAȚIE DE PUNERE PE PIAȚĂ PENTRU LECANEMAB CA TRATAMENT PENTRU BOALA ALZHEIMERICĂ PRECOCE ÎN EUROPA | Biogen. Biogen | Relații cu investitorii, 10 ianuarie 2023.
- Eisai inițiază depunerea de date BLA pentru Lecanemab în China | Biogen. Biogen | Relații cu investitorii, 22 decembrie 2022.
- Carvalho, Teresa, și Ray Burow. Lecanemab, pentru Alzheimer timpuriu, urmează să fie revizuit în Japonia. Alzheimer's News Today, 14 martie 2022.
- Actualizare privind cererea de reglementare pentru Aducanumab în Uniunea Europeană | Biogen. Biogen | Relații cu investitorii, 22 aprilie 2022.
- Swift, Rocky, et al. Eisai-Biogen Alzheimer's drug difficult to assess-Japan ministry. Reuters, 22 decembrie 2021.