Care sunt cele mai noi imunoterapii pentru cancerul de col uterin și cum să le introducem imediat în Polonia?


Care sunt cele mai noi imunoterapii pentru cancerul de col uterin și cum să le introducem imediat în Polonia?


Când va fi disponibil pentru pacienții din Elveția cel mai nou medicament împotriva bolii Alzheimer (și cum să îl obțineți mai repede)?


Noul medicament pentru Alzheimer este disponibil pentru pacienții elvețieni și cum îl puteți obține?


Un nou medicament eficient și sigur pentru scăderea trigliceridelor la pacienții cu FCS este acum disponibil. Dar când va fi disponibil pentru dumneavoastră?

Când va fi disponibil în Europa și în Regatul Unit primul medicament aprobat pentru ficatul gras cu fibroză?


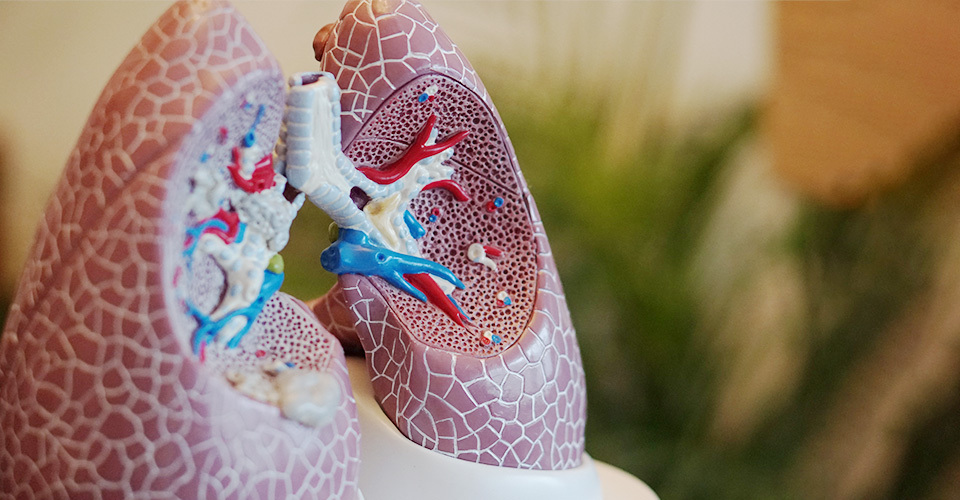
Când va fi disponibil noul medicament pentru BPOC pentru pacienții din Europa și Regatul Unit (și cum să nu așteptați)?

Când va fi disponibilă pentru pacienții din Europa prima terapie țintită pentru cancerul gastric și GEJ CLDN 18.2-pozitiv?

Când va fi disponibilă prima terapie țintită pentru leucemia acută cu translocație KMT2A în afara SUA?

Când va fi disponibil primul medicament pentru NPC pentru pacienții din Europa, Regatul Unit și nu numai (și cum să nu așteptați)?


Când va fi aprobată prima terapie țintită pentru BTC care exprimă HER2? Totul despre termene și opțiunile dumneavoastră între timp.


Toate opțiunile sigure și legale de a accesa Leqembi în timp ce acesta așteaptă aprobarea UE.

Iată o prezentare generală a fiecărui medicament pentru a vă ghida pe dumneavoastră și pe medicul dumneavoastră atunci când luați o decizie de tratament pentru fibroza chistică: 
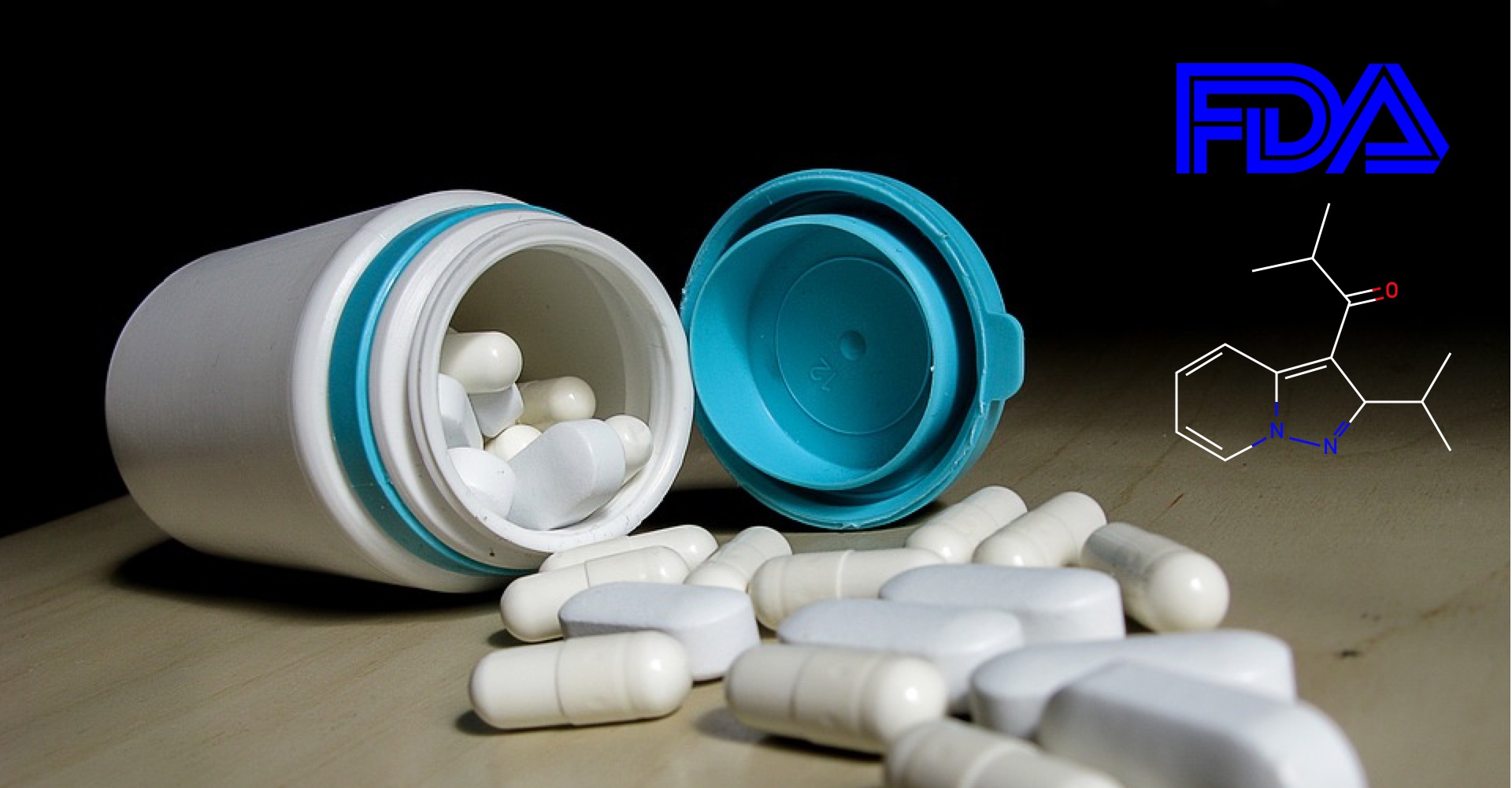
Nourianz istradefylline), tratamentul împotriva bolii Parkinson de la Kyowa Hakko Kirin, primește aprobarea FDA ca terapie suplimentară la levodopa.

Radicutedaravone), care a demonstrat că încetinește progresia SLA, este acum aprobat pentru pacienții din China.

Orkambi și Symkevi au fost respinse de Consorțiul Scoțian pentru Medicamente (Scotland Medicines Consortium - SMC) din cauza concluziei conform căreia costurile depășesc beneficiile.

Vitrakvi larotrectinib) recomandat de CHMP pentru aprobare în UE.

Un nou medicament împotriva cancerului de piele este acum aprobat în UE pentru adulții cu carcinom cutanat cu celule scuamoase metastatic sau local avansat.

Vyndaqel tafamidis) este acum aprobat în SUA după ce studiul a arătat o rată crescută de supraviețuire și o reducere a timpului de spitalizare din cauza problemelor legate de inimă.

Aprobarea următoarei faze a studiilor clinice aduce pacienții cu scleroză laterală amiotrofică cu un pas mai aproape de a avea acces la un nou tratament despre care s-a demonstrat că încetinește progresia bolii.
Pe baza rezultatelor promițătoare din studiile clinice de fază III, Health Canada a decis să extindă utilizarea Kalydeco (ivacaftor) pentru a include copiii cu vârste cuprinse între 1 și 2 ani.

Un studiu clinic recent indică faptul că Symdeko (tezacaftor/ivacaftor) poate îndepărta în siguranță și eficient mucusul gros și lipicios la copiii cu vârste cuprinse între 6 și 11 ani.

Studiul de fază III arată că Copiktra duvelisib) poate fi o opțiune pentru pacienții cu leucemie limfocitară cronică recidivantă sau refractară și limfom limfocitar mic.

Onpattro (patisiran) este un tratament de primă clasă care încetinește progresia amiloidozei ereditare cu transthyretină (hATTR).

Un nou medicament prezintă îmbunătățiri semnificative din punct de vedere statistic pentru pacienții cu cancer de prostată.

Australia asigură rambursarea medicamentelor pentru fibroza chistică.

Comisia Europeană a aprobat Alunbrig brigatinib) pentru tratamentul unui tip specific de cancer pulmonar.

 Potrivit cercetătorilor studiului, aproximativ o treime dintre pacienți ar putea beneficia de această terapie care poate oferi remisiuni, ameliorarea simptomelor și salvarea de vieți.
Potrivit cercetătorilor studiului, aproximativ o treime dintre pacienți ar putea beneficia de această terapie care poate oferi remisiuni, ameliorarea simptomelor și salvarea de vieți.
2018 a fost un an bun pentru noile tratamente împotriva cancerului, potrivit AACR din SUA. 
 Kisqali este acum singurul inhibitor CDK4/6 utilizat împreună cu un inhibitor de aromatază pentru tratamentul femeilor aflate în pre, peri sau postmenopauză în SUA.
Kisqali este acum singurul inhibitor CDK4/6 utilizat împreună cu un inhibitor de aromatază pentru tratamentul femeilor aflate în pre, peri sau postmenopauză în SUA.