Relyvrio întrerupt: Alternative de top și cum să vă continuați tratamentul
Ultima actualizare: 14 mai 2024

Puteți avea acces legal la medicamente noi, chiar dacă acestea nu sunt aprobate în țara dumneavoastră.
Aflați cumRelyvrio a adus o licărire de speranță pacienților cu scleroză laterală amiotrofică din SUA, odată cu aprobarea sa accelerată de către FDA în 2022. Cu toate acestea, scânteia medicamentului nu a durat mult. O aprobare EMA nu a venit niciodată după două respingeri. Iar în martie 2024, rezultatele studiului PHOENIX nu au reușit să demonstreze eficacitatea Relyvrio în rândul unei populații mai mari 1.
Pare inevitabil ca Relyvrio să fie întrerupt. Cu toate acestea, există peste 4 000 de pacienți din SUA care urmează acest tratament și poate mai mulți pacienți din întreaga lume care l-au accesat prin intermediul Importului de pacienți desemnați.
Dacă sunteți unul dintre aceștia, iată ce trebuie să știți despre studiul clinic eșuat al Relyvrio și despre alternativele dumneavoastră.
Studiul clinic eșuat al Relyvrio: Ce s-a întâmplat?
Atunci când Relyvrio a primit aprobarea accelerată în SUA, FDA a făcut o observație cu privire la dovezile insuficiente că medicamentul ar putea contribui la prelungirea supraviețuirii sau la încetinirea progresiei bolii la pacienții cu SLA 6. Cu toate acestea, la momentul respectiv exista (și încă există) o nevoie clară de tratament nesatisfăcută. Prin urmare, FDA a decis să avanseze cu aprobarea, în loc să aștepte rezultatele studiului de fază 3 PHOENIX.
Trecem rapid la începutul anului 2024 și rezultatele studiului PHOENIX au fost sub așteptări, ca să le spunem așa. După 48 de săptămâni de tratament, Relyvrio nu a prezentat niciun beneficiu semnificativ comparativ cu placebo. Beneficiul clinic a fost măsurat prin modificări ale scorului 1 al Scalei de evaluare funcțională ALS-Revised (ALSFRS-R).
De asemenea, nu au existat beneficii semnificative din punct de vedere statistic ale Relyvrio față de placebo cu privire la niciun alt rezultat secundar. Acestea au inclus scăderea capacității vitale lente, calitatea vieții, scăderea stadializării King și Milano-Torino, supraviețuirea fără ventilație și supraviețuirea pe termen lung 2.
Aceste rezultate au fost o surpriză negativă pentru mulți medici și pacienți. Mai ales având în vedere rezultatele studiului Centaur, în care Relyvrio a încetinit declinul scorului ALSFRS-R comparativ cu placebo, în special în ceea ce privește abilitățile motorii fine. Pacienții tratați cu Relyvrio au avut un risc de deces cu 44% mai mic, cu o supraviețuire mediană de 25 de luni, comparativ cu 18,5 luni pentru grupul de control. După 24 de luni, pacienții Relyvrio au avut o șansă de supraviețuire de 51,6% față de 33,9% pentru grupul placebo 7.
Cu toate acestea, datele sunt date. Ce se întâmplă în continuare?
Relyvrio este retras de pe piață?
Da. La 4 aprilie 2024, producătorul Relyvrio, Amylyx, a anunțat că a început procesul de retragere a Relyvrio de pe piață 3. Revocarea Relyvrio se va aplica ambelor piețe unde este aprobat - SUA și Canada. Potrivit comunicatului de presă al Amylyx, orice pacient care ia în prezent Relyvrio și dorește să își continue tratamentul, va fi trecut la un program gratuit 3.
Dacă sunteți afectat de retragerea Relyvrio de pe piață, iată câteva dintre opțiunile și alternativele dumneavoastră.
Care sunt alternativele tale la Relyvrio?
Dacă tu sau cineva drag ție ați luat Relyvrio, vestea eșecului studiului clinic trebuie să fie greu de suportat. Mai ales dacă ați avut rezultate bune cu acesta.
Cu toate acestea, există câteva măsuri pe care le puteți lua. Toate acestea necesită o discuție cu medicul curant.
Continuați să accesați Relyvrio prin intermediul producătorului
Dacă ați fost mulțumit de tratamentul Relyvrio și medicul dumneavoastră dorește să vă mențină pe acesta, puteți contacta Amylyx pentru a fi inclus în programul lor gratuit. Aceasta poate fi cea mai bună opțiune pentru dvs. și nu va avea nici consecințe financiare.
Din păcate, dacă ați luat Relyvrio într-o țară în care acesta nu a fost încă aprobat (prin regulamentul privind importul pacientului numit), programul gratuit s-ar putea să nu vi se aplice. Ar trebui să verificați cu Amylyx și să discutați situația dvs. individuală cu compania.
Dacă nu sunteți eligibil pentru programul gratuit și doriți să rămâneți pe Relyvrio, există o altă alternativă pe care trebuie să o discutați cu medicul dumneavoastră.
Înlocuiți Relyvrio cu ingredientele saleAmmonaps și Tudca)
Ingredientele active ale Relyvrio sunt sodium phenylbutyrate și taurursodiolul. Pentru a vă continua tratamentul cu Relyvrio după retragerea de pe piață a medicamentului, ați putea achiziționa ambele principii active și să le luați împreună.
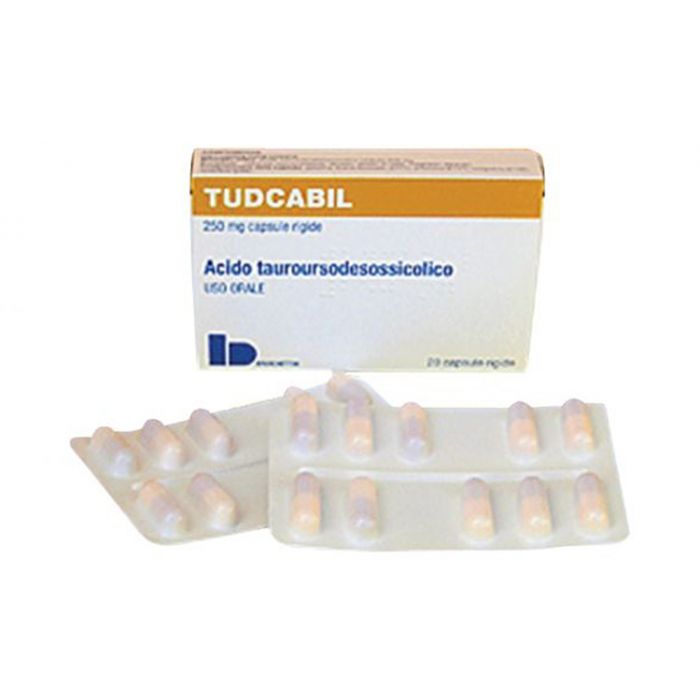
- Ingredientul nr. 1: Tudca. Taurursodiolul (denumit și tauroursodeoxycholic acid) poate fi achiziționat sub denumirea Tudca sau Tudcabil. Tudca este aprobat în Italia. Acesta este implicat în prezent într-un studiu clinic propriu pentru tratamentul SLA, pentru care a primit desemnarea de medicament orfan din partea EMA 8. Pentru a comanda Tudca în afara Italiei, puteți lua legătura cu echipa noastră de la Everyone.org. Vă vom ajuta să îl achiziționați și să îl importați în calitate de pacient desemnat.
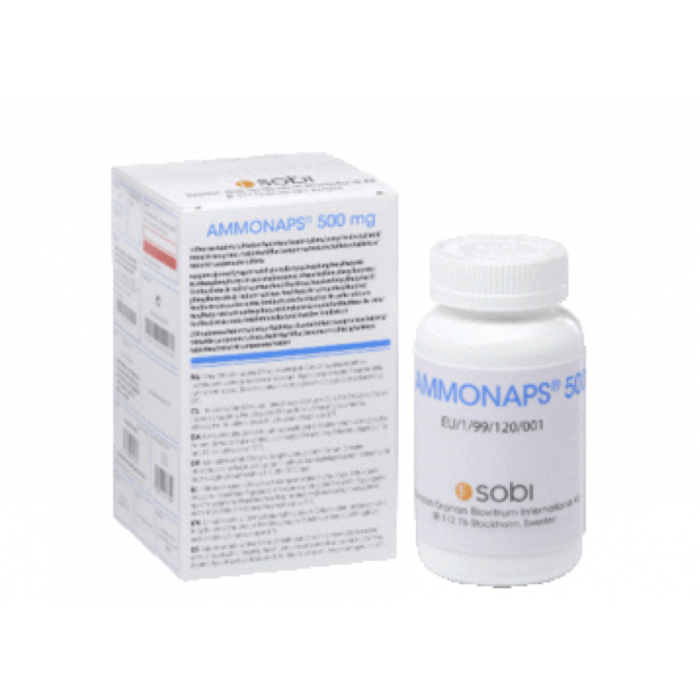
- Ingredientul nr. 2: Ammonaps. Sodium phenylbutyrate este disponibil pentru cumpărare sub denumirea de Ammonaps. Este aprobat de EMA și FDA pentru tratamentul tulburărilor ciclului ureei. Nu este aprobat nicăieri pentru tratamentul ALS. Cu toate acestea, medicul dumneavoastră vi-l poate prescrie în asociere cu Tudca pentru această indicație (cunoscută sub denumirea de prescripție off-label). Dacă aveți o rețetă, vă putem ajuta să obțineți medicamentul oriunde v-ați afla.
Alte alternative Relyvrio
Dacă nu ați început încă tratamentul cu Relyvrio sau nu ați obținut rezultatele dorite, ar trebui să explorați alte alternative. Mai jos sunt prezentate câteva opțiuni pentru a începe discuția cu medicul dumneavoastră.
-
edaravone
Cunoscut și ca Radicava sau Radicut, acest medicament este aprobat de FDA pentru tratamentul SLA. Deși edaravone nu are încă aprobarea EMA, ați putea să îl accesați de oriunde prin intermediul Importului de pacienți numiți. Totuși, veți avea nevoie de o rețetă de la medicul dumneavoastră.
edaravone este destinat să încetinească evoluția SLA. Studiile clinice din Japonia au arătat că pacienții tratați cu edaravone au prezentat un declin mai lent al abilităților funcționale în comparație cu cei care au primit un placebo 4.
Cu toate acestea, unele meta-analize nu au constatat o diferență semnificativă din punct de vedere statistic în scorurile capacității funcționale între pacienții edaravone și grupul de control 5. În ceea ce privește rezultatele supraviețuirii, o meta-analiză recentă a raportat o creștere semnificativă din punct de vedere statistic a ratelor de supraviețuire pentru pacienții cu SLA tratați cu edaravone comparativ cu cei cărora li s-a administrat un placebo 5.
Dacă acest medicament ar putea fi o opțiune pentru dumneavoastră, decizia aparține medicului dumneavoastră.
-
Rilutek riluzole)
Rilutek riluzole) a fost aprobat de FDA pentru tratamentul SLA din 1995. Acesta acționează prin modularea eliberării de glutamat, un neurotransmițător despre care se crede că joacă un rol în neurodegenerarea observată în ALS. Prin reducerea nivelului de glutamat, Rilutek urmărește să încetinească evoluția bolii.
Rilutek este disponibil pe scară largă în întreaga lume. Cu toate acestea, dacă nu este aprobat sau disponibil în țara dumneavoastră, îl puteți accesa oricum prin intermediul Importului pentru pacienți desemnați. Luați legătura cu echipa noastră dacă aveți o rețetă pentru Rilutek, dar nu aveți acces la medicament la nivel local.
Ce se întâmplă dacă o alternativă Relyvrio nu este disponibilă în țara dumneavoastră?
Pacienții cu SLA sunt frustrați (pe bună dreptate) de lipsa opțiunilor de tratament disponibile. La fel de frustrant este să știi că există o opțiune, dar să trebuiască să aștepți până când aceasta este disponibilă în țara ta.
Vestea bună este că, orice opțiune care este aprobată undeva în lume, o puteți obține oriunde prin intermediul Named Patient Import. Everyone.org este specializată în a ajuta pacienții să aibă acces la tratamentele de care au nevoie, indiferent de locul în care acestea sunt aprobate. Dacă medicul dumneavoastră decide să înlocuiască Relyvrio cu ingredientele sale, să vă treacă la edaravone sau să opteze pentru o altă opțiune, fiți siguri că puteți obține tratamentul de care aveți nevoie.
Pur și simplu luați legătura cu noi și trimiteți-ne rețeta dumneavoastră. Vom face tot posibilul să vă ajutăm, astfel încât întreruperea tratamentului cu Relyvrio să nu vă perturbe tratamentul.
Referințe:
- Studiul PHOENIX al AMX0035 nu a îndeplinit obiectivele finale - Societatea ALS din Canada. Societatea ALS din Canada, 8 martie 2024.
- Meglio, Marco. Amylyx se gândește la retragerea AMX0035 în urma constatărilor dezamăgitoare din faza 3 PHOENIX. NeurologyLive, 8 martie 2024.
- Cheng, Mira. Medicamentul Relyvrio pentru SLA retras de pe piață după eșecul studiului clinic. CNN, accesat la 14 mai 2024.
- eficacitateaedaravone în scleroza laterală amiotrofică cu capacitate vitală forțată redusă: Analiza post-hoc a studiului 19 (MCI186-19) [studiu clinic NCT01492686]. NCBI, 14 iunie 2022.
- Siguranța și eficacitatea edaravone la pacienții cu scleroză laterală amiotrofică: o revizuire sistematică și o meta-analiză. Neurological Sciences, accesat la 14 mai 2024.
- Novins, Olivia, et al. Aprobarea Relyvrio: Lessons Learned. Parexel, accesat la 14 mai 2024.
- Trial of Sodium Phenylbutyratefor Amyotrophic Lateral Sclerosis. The New Englang Journal of Medicine, accesat la 14 mai 2024.
- EU/3/17/1844 - desemnare orfană pentru tratamentul sclerozei laterale amiotrofice. Agenția Europeană pentru Medicamente, 31 martie 2017.